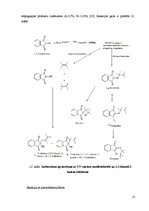
| Nr. | Название главы | Стр. |
| IEVADS | 3 | |
| 1. | LITERATŪRAS APSKATS | 4 |
| 1.1. | Indāntriona raksturojums | 4 |
| 1.2. | Fizikālās īpašības | 4 |
| 1.3. | Ķīmiskās īpašības | 5 |
| 1.4. | Lietošana | 17 |
| 1.5. | Iegūšanas metodes | 21 |
| 2. | EKSPERIMENTĀLĀ DAĻA | 25 |
| 2.1. | Sintēzes apraksts | 25 |
| 2.2. | Reaģenti un darba gaita | 26 |
| LITERATŪRAS APSKATS | 28 | |
| PIELIKUMS | 33 |
1.2. Fizikālās īpašības
Ninhidrīns šķīst etanolā, bet izskristalizējoties veido blāvi dzeltenas prizmas. Ūdenī veido dzeltenu šķīdumu un šķīst arī citos polāros šķīdinātājos.
Ja karsē kā cietu vielu, tad 120 – 130 0C parādās rozā, sarkana vai sarkani brūnā krāsa, bet 130 – 140 0C iegūst tumši sarkanu purpurkrāsas savienojumu. Temperatūru paaugstinot vēl vairāk, ninhidrīns strauji kūst un sadalās pie 241 0C.
Saules gaismā ninhidrīns kļūst sarkans, tāpēc jāuzglabā vēsā, sausā vietā. Ja ninhidrīnam pievieno tionihlorīdu vai arī karsē vakuumā, tad iegūst 1,2,3–indāntrionu tumši sarkanu adatveidu kristāliskā formā. Indāntrionu var iegūt arī, ninhidrīnu apstrādājot ar koncentrētu sērskābi, bet paaugstinot temperatūru, iegūst bisindāndionu [3].
1.3. Ķīmiskās īpašības
Hidratēšanas reakcija
Specifiskā indāntriona hidratēšanās reakcijā ar divām ūdens molekulām veidojas 2,2 – dihidroksiindān- 1,3-dions (ninhidrīns). Pārejas stāvoklī viena ūdens molekula karbonilgrupai pievienojas kā nukleofīls, bet otrai ūdens molekulai ir skābes īpašības un tā pārnes protonu uz karbonilgrupas skābekļa atomu. Pārejas produkts satur divas ar ūdeņraža saitēm saistītas ūdens molekulas, ļoti līdzīgi kā dialdehīdos. Hidratācijai 25°C temperatūrā 96,7% dioksāna/ ūdens vidē lietoja pielāgotu Hammeta vienādojumu un ieguva Hammeta reakcijas konstanti 1,05, kas norāda uz ievērojamu negatīvā lādiņa veidošanos pie reakcijas centra. (skatīt 2.attēlu) [4].…
Indāntriona savienojumam tika pievērsta liela uzmanība sākot ar 1911. gadu, kad tika atklāts Ruhemana purpurkrāsas savienojums reakcijā ar aminoskābēm. 1954. gadā zviedru pētnieki Odens un Hofstens atzina to kā piemērotu reaģentu pirkstu nospiedumu noteikšanai. Vairākas zinātnieku grupas centās iegūt ninhidrīna savienojumu caur dažādiem sintēzes ceļiem ar iespējami lielāko teorētisko iznākumu. 1910. gadā Kembridžas Universitātē profesora Zigfrīda Ruhemana vadībā tika iegūts 1,2,3 – indāntriona savienojums reakcijā ar 1-indānionu un p-nitrozodimetilanilīnu. Iegūtais 1,2,3 - indāntrions pastāv tikai bezūdens apstākļos. Lielu ieguldījumu par diketonu un triketonu izpētē deva padomju ķīmiķis, organiskās ķīmijas speciālists, Latvijas PSR Zinātņu Akadēmijas akadēmiķis G. Vanags, kas kopā ar A. Loidu 1983. gadā veica pētījumus par ninhidrīna iegūšanu sadalot 2 – nitro -1,3- indāndionu dažādos apstākļos. 1963. gadā Bekers un Rasels publicēja ninhidrīna sintēzi ar teorētisko iznākumu 99%. Indāntrionu galvenokārt pielietoja tiesu zinātne balsoties uz kolorimetrijas principu. Mūsdienās tā pielietošanas spektrs ir kļuvis ļoti plašs, pielietojot to mikrobioloģijā un medicīnā, bioķīmijā, pārtikas ķīmijā, lauksaimniecībā vides ķīmijā, u.c jomās, kurās ir nepieciešami pētījumi ar aminoskābēm. Indāntriona - Šifa bāzes krāsu metodes analīze radīja plašu interesi par tās pielietošanas iespējām histoķīmijā. Darba mērķis – apkopot pieejamo literatūru un iepazīties ar savienojumu iegūšanas vēsturi, izmantošanas veidiem, fizikālajām un ķīmiskajām īpašībām. Darba uzdevums – atrast savienojuma iegūšanas sintēzi ar lielāko teorētisko iznākumu un aprakstīt to eksperimentālajā daļā.